猪圆环病毒相关疾病(PCVD)引起仔猪高死亡率、低效生产率,是近十年来严重影响我国养猪业的传染病,其临床表现以断奶仔猪多系统消耗综合征(postweaning multisystemic wasting syndrome , PMWS) 为主。该传染病主要侵害6~8 周龄仔猪, 引起仔猪淋巴系统疾病、渐进性体重下降、呼吸道症状及黄疸, 造成患猪免疫机能下降、生产性能降低。目前,部分猪场已经通过加强饲养管理与药物控制等方案进行综合预防和控制,虽然取得一些效果,但是尚不能完全控制该病的流行。今年来多家疫苗生产企业相继研发并生产出猪圆环病毒疫苗,为有效控制该病带来新的手段。但不同公司产品使用方案不尽相同,为了有效评估使用的猪圆环病毒2型灭活疫苗对猪场的作用,开展以下的研究工作。
1 材料与方法
1.1 材料
猪圆环病毒2型灭活疫苗(批号120317,购自普莱柯生物工程股份有限公司)
试验猪场及试验用哺乳仔猪,上海某猪场
猪圆环病毒2型抗体检测试剂盒(批号120501,购自天津瑞普生物药品有限公司)
PCR诊断试剂盒(批号0831,购自上海天根生物科技有限公司)
PCR检测仪,购自东胜仪器公司,东胜龙黑金刚型号EDC-810-5
超速离心机,美国热电公司micro17
电泳仪电泳漕,JY-SP3,JY200C
成像系统,上海领成Tocan320
酶标仪 MK3型 美国热电公司
1.2方法
1.2.1 随机挑选16头即将于1周内生产的怀孕母猪,并分为2组(A组和B组),每组8头。
![]() 作者简介:杜根成(1977- ),男,执业兽医师,硕士研究生,从事猪病防控工作, 电话:13598820673,E-mail:yellowriver2000@163.com
作者简介:杜根成(1977- ),男,执业兽医师,硕士研究生,从事猪病防控工作, 电话:13598820673,E-mail:yellowriver2000@163.com
*通讯作者:张立昌 hoggyzhang@hotmail.com
母猪分娩后,所有A组母猪所产的仔猪于14日龄免疫猪圆环病毒2型灭活疫苗,肌肉注射1毫升/头;35日龄加强注射一次,肌肉注射1毫升/头;B组母猪所产仔猪为对照组,不免疫猪圆环病毒2型灭活疫苗。
1.2.2 试验母猪分娩时统计产子数、产子窝重、仔猪初生重、活仔数;断奶后,统计免疫组及对照组3周龄、4周龄、6周龄、8周龄的成活率。
1.2.3 体温检测:在免疫猪圆环病毒2型灭活疫苗前、免疫后1天、2天、3天、4天,随机对免疫组和对照组的各15头仔猪进行体温检测,并记录体温,同时观察猪群是否出现临床副反应如精神状态不佳、拉稀、采食下降、神经症状等。
1.2.4 称重:统计增重情况,试验猪分别在出生当天、1、2、3、4、6、7、8周龄
进行称重,并分析仔猪的增重情况,统计分析体重均一度(离散度)。
1.2.5 抗体检测:在A组、B组中各选择15头仔猪分别在免疫前(2周龄)、免疫后一周(3周龄)、二免后一周(6周龄)、二周(7周龄)采血,ELSIA方法检测PCV-2的抗体。
1.2.6 PCR方法检测病毒血症
上游引物PCV2F1096:5’-GGATATTGTAG(T)TCCTGGTCG-3’,下游引物PCV2R1588:5’-TCCCG-
CACCTTCGGATATAC-3’。引物所在区域为PCV2高度保守的衣壳蛋白编码区。扩增的目的片段大小分别为493bp。
反应体系:PCF1096 (10µM/µl) 0.5µl,PCF1588(10µM/µl) 0.5µl,2 × Mixture12.5µl,dd H2O8.5µl,DNA模板3µl,总体系25µl。反应条件为:95℃预变性5 min,94℃变性 30s,58℃退火30s,72℃延伸30s,40循环后,72℃温育10min。25µl PCR产物在1%的琼脂糖凝胶上90V条件下,电泳40min,凝胶成像仪下观看并成像。
2.结果
2.1 统计仔猪成活率 比较免疫组和对照组的仔猪成活率,仔猪3周断奶时的免疫组成活率为91.8%,高于对照组的78.57%。4周龄免疫组成活率为98.65%,也高于对照组成活率90.91%;因此,仔猪免疫猪圆环病毒2型灭活疫苗能有效提高仔猪成活率,详细结果见表1、表2。
表1 3周龄和4周龄免疫组与对照组成活率统计表
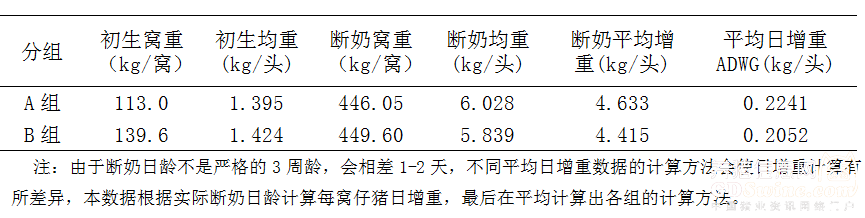
2.2 断奶增重统计 经过对A组、B组断奶重于初生重的比较和统计分析,结果表明,免疫组平均增重为0.2241Kg/头/日;对照组只有0.2052Kg/头/日。免疫组要比对照组多增重0.0189Kg/头/日。因此,在仔猪阶段免疫可以提高仔猪的日增重(ADG),详细见表2。
表2 断奶日增重统计比较表
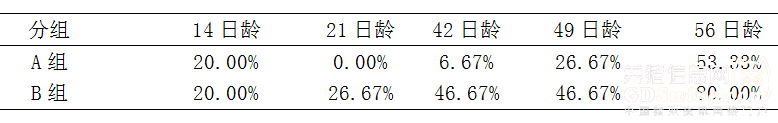
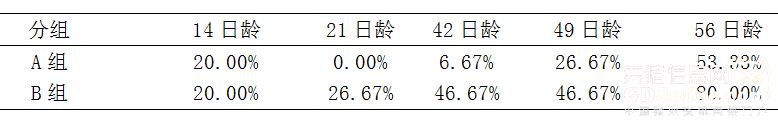
2.3 仔猪断奶后,分别于21日龄、28日龄、42日龄、56日龄称重,经统计结果表明,保育舍日增重免疫组略优于对照组,而且免疫猪群在21日龄、28日龄、42日龄、56日龄的离散度分别是0.11、0.09、0.09、0.15均低于对照组的0.14、0.12、0.15、0.34,说明猪群免疫后生长的均一度也好于对照组,详细结果见表3。 注:由于断奶日龄不是严格的3周龄,会相差1-2天,不同平均日增重数据的计算方法会使日增重计算有所差异,本数据根据实际断奶日龄计算每窝仔猪日增重,最后在平均计算出各组的计算方法。
表3 免疫组与对照组在保育阶段平均体重统计表
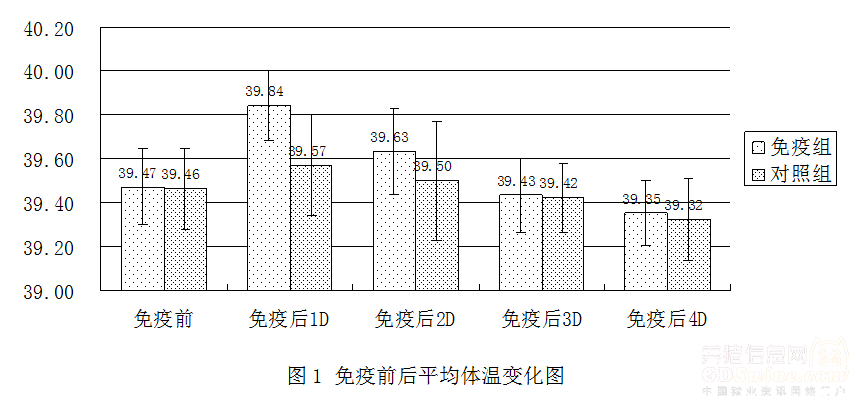
2.4 体温测量及临床观察 免疫前后对仔猪进行体温检测和临床观察,结果表明,免疫组在疫苗免疫后1天有体温升高平均体温升至39.84℃,高于对照组,体温在第2天后逐步恢复正常。详细结果见图1。免疫组仔猪,在免疫后1天出现1头仔猪精神沉郁,采食减少,第2天,采食量回复,第3天恢复正常,其他的仔猪都表现正常,免疫2天后所有免疫组仔猪均恢复正常。对照组只在第1天有一头猪出现精神沉郁。
图1 免疫前后平均体温变化图
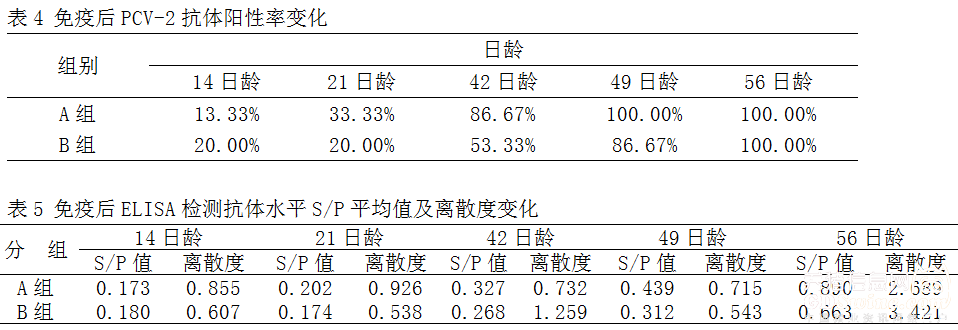
2.5 抗体水平 免疫仔猪后,经ELISA试验检测PCV-2的抗体水平,试验结果表明,猪圆环病毒2型灭活疫苗免疫后免疫组A组抗体水平转阳率比对照组要高、转阳时间比对照组要早,而且第二次加强免疫后抗体转阳率更高,在49天全部转阳,详细结果见表4;S/P值的数据分析表明免疫组的抗体水平也要高于对照组,而且离散度在42天和49天时小于对照组,详细结果见表5。
2.6 PCR检测病毒血症 分别对免疫前后仔猪采血,PCR检测仔猪病毒血症。检测结果表明,免疫一次PCV-2疫苗后仔猪群病毒血症阳性率会明显下降,随后与对照组一样,逐步回升,但是,相同日龄的病毒血症阳性率明显低于对照组,详细结果见表6。
表6 PCR检测病毒血症阳性率变化
3.讨论
3.1 本次田间试验,通过检测仔猪圆环病毒2型的ELISA抗体,发现免疫仔猪初期抗体水平较低,后期随日龄增大而抗体水平升高,这可能与母源抗体不高,猪场存在野毒感染有关。本次试验,怀孕母猪没有免疫猪圆环病毒2型灭活疫苗,所以,母源抗体不会很高也不整齐。此外,在做实验期间正处于8月份,天气炎热,与母猪奶水不足也有一定关系。其次,仔猪抗体水平随日龄增长而升高,免疫组抗体水平的增加与免疫的猪圆环病毒2型灭活疫苗直接相关,尤其是在加强免疫后,抗体转阳率高于对照组。这说明,免疫猪圆环病毒2型灭活疫苗起到一定作用。对照组仔猪抗体水平的增加,可能PCV-2野毒感染有关。对照组经过自然感染,抗体水平逐步提高,至保育后期,抗体水平和免疫组相当。这也提醒我们,仅仅依靠检测PCV-2抗体水平对疫苗质量进行评估是不够的。
3.2 免疫后,免疫组仔猪体温出现升高现象,这可能与疫苗产生免疫刺激有关。本研究采用的疫苗佐剂为水包油包水类型,免疫刺激相对要强些,但是,体温在免疫后2天便自行恢复。体温升高会造成极少数的仔猪出现精神沉郁,这种情况也会在2天后自行恢复。
3.3 从PCR检测仔猪病毒血症的结果来看,免疫后病毒血症明显下降,说明接种猪圆环病毒2型灭活疫苗可以降低仔猪病毒血症,但是,随仔猪生长,对照组仔猪发生病毒血症的比例会逐渐升高,同时,免疫组病毒血症也有所增加,只是免疫组的病毒血症发生比例低于对照组。这说明,免疫疫苗对控制猪圆环病毒血症有一定帮助;此外,免疫过猪圆环病毒2型灭活疫苗的猪群仍可感染PCV-2,而且,随着免疫时间增长,感染比例也会增加,这与有关文献报道是一致的。
3.4 从仔猪哺乳阶段的成活率统计结果来看,免疫猪圆环病毒2型灭活疫苗有助于提高仔猪的生长,尤其是成活率、日增重等指标,例如断奶日增重统计中,免疫组高于对照组18.9克/天。
3.5 保育舍的增重统计结果表明,对照组与免疫组差异不明显,这与生产(试验)过程中,对照组已经淘汰掉了生长不良仔猪,只统计可生长良好的仔猪有关;尽管如此,免疫组的各日龄体重的离散度仍然小于对照组体重的离散度,这说明免疫组猪群生长的均一度好于对照组。
3.6 本次试验出现病毒血症阳性比率与ELISA抗体阳性率同步增长现象,可能与本试验过程中所测到的ELISA抗体并非中和抗体有关。
总体而言,在PCV-2感染猪场,尤其是已经表现出PCV-2相关疾病,如PMWS等临床症状的猪群,仔猪免疫猪圆环病毒2型灭活疫苗有助于降低病毒血症、提高仔猪成活率,促进仔猪生长。
参考文献:
[1] 陈溥言.兽医传染病学[M].5版.北京:中国农业出版社,2007:231-234.
[2] 陈溥言,芦银华,华修国. 断奶仔猪多系统消耗综合征[J].畜牧与兽医,2002,34(7).
[3] 王忠田,杨汉春.规模化猪场猪圆环病毒2型感染的流行病学调查[J].中国兽医杂志,2010,49(5):3-4.
[4] Galindo-Cardikl,L. Grau-Roma,M. Perez-Maillo,J. Segales. Characterization of Necrotizing Lymphadenitis Associated with Porcine Circovirus Type 2 Infection [J]. Journal of Comparative Pathology, Volume 144, Issue 1, January 2011, Pages 63-69.
[5] 王宪文,杭柏林,赵普等. 猪圆环病毒2型感染细胞凋亡研究进展[J]. 动物医学进展,2010,31(12):124-127
[6] Joaquim Segales. Porcine circovirus type 2 (PCV2) infections: Clinical signs, pathology and laboratory diagnosis [J]. Virus Research, Volume 164, Issues1-2, March 2012, Pages10-19.
[7]T. Kekarainen, K. McCullough, M. Fossum, J. Segales, G.M.Allan. Immune
responses and vaccine-induced immunity against Porcine circovirus type 2 [J]. Veterinary Immunology and Immunopathology, Volume 136, Issues 3-4, 15 August 2010, Pages 185-193.
[8] Nathan M. Beach, Xiang-Jin Meng. Efficacy and future prospects of commercially available and experimental vaccines against porcine circovirus type 2 (PCV2) [J]. Virus Research, Volume 164, Issues1-2, March 2012, Pages 33-42.
(来源:普莱柯生物工程股份有限公司 作者:杜根成,郭小参,徐祥臣,阮坤祥,张立昌)
| 查看所有评论 最新评论 |
|
|
| 发表评论 | ||||
|