隐孢子虫隶属原生动物门(Protozoa)、顶复亚门(Apicomplexa)、孢子虫纲(Sporozoasida)、球虫亚纲(Coccidiasina)、真球虫目(Eucoccidiorida)、艾美耳亚目(Eimeriorina)、隐孢子虫科(Cryptosporidiidae)、隐孢子虫属(Cryptosporidium),是一种重要的肠道寄生性原虫。它具有广泛的宿主谱,可感染人、家畜、伴侣动物、野生动物、鸟类、爬行类、鱼类等240多种动物,引起重要的人兽共患隐孢子虫病,具有显著的经济意义和公共卫生意义。隐孢子虫病(Cryptosporidiosis)主要通过粪-口途径经水源、空气、食物等传播,以胃肠黏膜上皮细胞损伤性腹泻和卡他性呼吸道炎症为典型临床症状,引起低龄动物生产性能下降或死亡,对于婴幼儿和免疫缺陷患者可致慢性、致死性疾病(Leitch & He, 2012)。目前该病已被列为世界最常见的6种腹泻疾病之一,由隐孢子虫感染引起的儿童腹泻已经成为仅次于轮状病毒感染的第二大腹泻病因,也是引发1-2岁婴幼儿感染死亡的主要原因(Kotloff et al., 2013)。同时,隐孢子虫感染对艾滋病患者的致死率高达61%左右,也是诱发艾滋病病人死亡的重要因素之一(Fayer, 2004)。
隐孢子虫种类较多,1907年由捷克著名学者Ernest Edward Tyzzer首次从实验小鼠消化道上皮细胞发现虫体,并于1910年对其命名为鼠隐孢子虫(Cryptosporidium. muris)(Tyzzer, 1910)。随后于1976年,Nime(Nime, et al., 1976)及他的研究团队首报道了人的隐孢子虫病,直到1982年美国费城和洛杉矶的大量感染病例出现,且表现出与艾滋病密切相关次,该病逐渐开始引起医学界的广泛关注(1982)。1993年(Mac et al., 1994)美国威斯康辛州密尔沃基市出现历史记载以来最严重的一次由城市饮用水水源污染导致的隐孢子虫病大爆发,将隐孢子虫的公共卫生意义推向了一个新的高度。中国首例人隐孢子虫病例是1987年韩范等(韩范等, 1987)于南京市发现,随后在我国山东、湖南、福建、内蒙、安徽、河南等省份陆续有所报道。随着分子流行病学研究方法的不断完善,目前已在人、哺乳动物、禽类、爬行类和鱼类等体内鉴定出27个有效种,40多个基因型(Fayer & Santin, 2009; Fayer et al., 2010; Plutzer & Karanis, 2009; Ryan et al., 2014)。其中人兽共患隐孢子虫有6个公认的有效种,分别为微小隐孢子虫(C. parvum)、火鸡隐孢子虫(C. meleagridis)、鼠隐孢子虫(C. muris)、猪隐孢子虫(C. suis)、犬隐孢子虫(C. canis)和猫隐孢子虫(C. felis)。隐孢子虫是一种水源性病原,其卵囊随粪便排出体外后,可在水体中存活数月,水源性传播目前也是隐孢子虫病传播的重要途径之一。随着社会工业化进程的推进,畜禽及动物与人类的接触愈发密切,经由感染者排出的隐孢子虫卵囊污染饮用水或娱乐场所水源所引起的相互传播感染,无论对于免疫缺陷个体还是正常个体来说都是一个不容忽视的公共卫生问题(Baldursson & Karanis, 2011; Chalmers, 2012)。本文就近年来国内外在人兽共患隐孢子虫的病原学、体外培养、流行病学、致病性、检测和防治等方面的研究进展做一综述。
1 病原
1.1 生物学特征
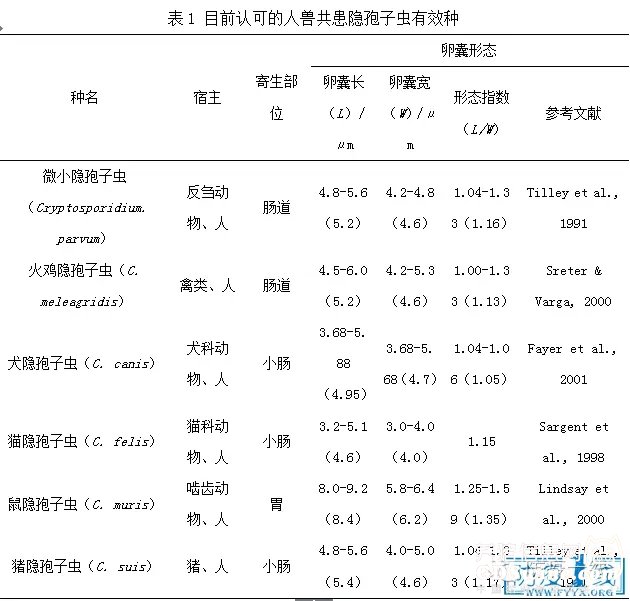
目前被认可的6个人兽共患隐孢子虫有效种包括微小隐孢子虫(C. parvum)、火鸡隐孢子虫(C. meleagridis)、鼠隐孢子虫(C. muris)、猪隐孢子虫(C. suis)、犬隐孢子虫(C. canis)和猫隐孢子虫(C. felis)。各种隐孢子虫卵囊形态基本相似,均为圆形或椭圆形,囊壁光滑,其上有裂缝。随粪便排出的卵囊为厚壁卵囊,具有两层囊壁,内部隐约可见4个裸露的香蕉形子孢子,少数卵囊内可以看到残体。改良抗酸染色隐孢子虫卵囊呈玫瑰红色,轮廓呈球形或亚球形,可见较薄的膜及弯月形的空泡。不同种的隐孢子虫大小、寄生部位具有一定的差别(见表1)。
虽然到目前为止,顶覆门原虫隐孢子虫仍然被分类在真球虫目,但是基因组和生化特征研究数据显示,隐孢子虫同顶复门其他成员如弓形虫、环孢子虫和肉孢子虫存在很大的差别,它缺失了顶质体细胞器以及质体和线粒体基因组(Abrahamsen et al., 2004; Xu et al., 2004; Zhu et al., 2000)。除此之外,它还具有很多独特的特征包括:内生发育阶段是在宿主细胞胞质外进行;在纳虫空泡膜基础上,形成独特的营养摄入器官;存在薄壁卵囊和厚壁卵囊两种形态,前者可以实现感染者体内的自发感染并完成生活史;卵囊形态较小,同时缺少孢子囊、极粒、卵膜孔等形态结构;对现有的所有抗球虫药物均不敏感。新的研究发现(Koh, et al., 2014; Ryan et al., 2014),相对于球虫,隐孢子虫生物学特征与原始的顶复门簇虫更加接近,如隐孢子虫生活史中配子母细胞样胞外发育阶段与簇虫非常相似之处,同时抗隐孢子虫多克隆抗体与簇虫有交叉反应。Templeton等(Templeton et al., 2010)将隐孢子虫与簇虫(Ascogregarina taiwanensis)的全基因组数据比较研究进一步证实二者确实存在较近的种系发育关系。然而,隐孢子虫、簇虫依然具有与球虫相同的大多特征:包括体外的卵囊阶段、I型脂肪酸代谢途径、聚酮合成酶以及一系列保守的胞外蛋白结构域等。究竟隐孢子虫和簇虫是怎样的种系发育关系,仍需进一步的研究来阐释,明晰隐孢子虫与其的关系对隐孢子虫病的流行病学防控亦具有重要意义。
1.2 基因组特征
C. parvum, C. hominis 和C. muri三种隐孢子虫的全基因组测序工作的完成为更好的掌握隐孢子虫的分子生物学特征奠定了重要基础。其中,C. parvum和C. muris更兼具了人兽共患公共卫生意义。Windemer等(Widmer & Sullivan, 2012)研究表明C. parvum和C. hominis基因组DNA序列存在95%-97%的序列特异性,GC含量约为30%,没有大的插入/缺失片段或明显的重组。二者的全基因组长度均为9.2Mb,共编码4000个基因。
目前C. parvum基因组是唯一一个完成全部组装的隐孢子虫基因组,对应8条染色体,有大约75.3%的编码基因被注释。隐孢子虫同簇虫类似,缺少顶质体,缺少线粒体基因组,有核基因编码具有线粒体功能的蛋白,负责参与三羧酸循环,有氧氧化、脂肪酸代谢等能量代谢过程。代谢途径上相关基因的缺失也在一定程度上说明了隐孢子虫的营养来源很大程度上是直接从宿主细胞中获取,而非从头合成完成来完成糖酵解、底物磷酸化等能量代谢。Widmer等(Widmer et al., 2012)曾经对只感染人的C. parvum IIc株和人兽共患C. parvum IOWA株进行了全基因组比较,发现二者存在一部分高度分歧的基因,且C. parvum IIc株和C. hominis的相似性显著高于C. parvum IOWA株。推测这与C. parvum IIc株和C. hominis二者都只感染人,虫体在长期的进化过程中形成了以对不同种类宿主的适应性为前提的进化模式。
C. muris全基因组草图于2008年公布,它与C. parvum和C. hominis 在基因组大小、核苷酸组成以及基因含量上基本相似,仅存在少许关键差异:它存在完整的一套由核基因编码的三羧酸循环酶和ATP合成酶来完成氧化磷酸化过程(Mogi & Kita, 2010; Widmer & Sullivan, 2012)。C. muris虽然与C. parvum和C. hominis一样缺少线粒体基因组,但是它与簇虫一样存在线粒体的结构和蛋白。这在一定程度上证明了隐孢子虫和簇虫可能存在共同的祖先,它们早期都具有线粒体结构和蛋白,C. parvum和C. hominis线粒体的缺失是发生在从C. muris 分化出来以后进化完成的(Widmer & Sullivan, 2012)。
早期隐孢子虫的功能基因组学研究相对比较滞后,这与隐孢子虫复杂的发育阶段缺少稳定的转染系统以及有效的内源性启动子相关。随着分子生物学技术的进步,这些难题将逐步被攻破。Li等(Li et al., 2014)利用限制性酶介导的调控技术成功将黄色荧光蛋白和红色荧光蛋白转染入隐孢子虫体内。Beverley 等(Beverley, 2015)利用Crispr cas9技术成功实现了对隐孢子虫基因组的编辑,为新的功能蛋白的研究提供了稳定的技术支撑,实现了隐孢子虫功能基因组学研究的新飞跃。
1.3 系统分类及宿主特异性
对于隐孢子虫的分类命名,由于缺少原虫分类的一致性规则,经典的孟德尔遗传种间繁育定律在原虫上难以操作,早期学术界对于分类问题一直存在很大的争议。随着分子生物学研究技术的发展,主要依据虫体卵囊形态与寄生部位、宿主病理变化和临床症状等的传统分类学方法已不再适用于隐孢子虫的种间分类。目前,普遍认可Xiao等(Xiao et al., 2004)提出的命名隐孢子虫新种的基本规则,命名新种所需信息包括:卵囊的形态学数值资料、遗传学特征(提供多基因位点的遗传信息)、鉴别并证明自然感染宿主及试验感染宿主的特异性、遵守国际动物学命名规则(ICZN)。人兽共患隐孢子虫是构成公共卫生传播威胁的主要因素,目前被认可的6个有效种无论是对免疫缺陷个体还是正常个体均可造成感染,其中C. parvum 是最常见也是报道最多的种类。大多数的隐孢子虫表现出一定的宿主特异性,但不是非常严格,例如C. parvum,尤其是II型表现出非常弱的宿主特异性,可以感染鼠、牛、人、马等众多哺乳动物实现人兽共患传播感染。相反,C. meleagridis, C. canis, C. felis和C. muris 表现出相对较强的宿主特异性,除了感染人外,分别感染禽、犬、猫和猪(Fayer, 2004)。早期研究认为,C. hominis 具有非常强的宿主特异性只感染人,但Morgan等(Morgan et al., 2000)人研究发现,C. hominis 亦可感染海洋哺乳动物儒艮,从而打破了宿主专一性。此外,研究发现在实验室条件下C. hominis还可感染羔羊、猪和小牛,但是不感染免疫抑制小鼠。Xiao、Ryan等(Ryan, 2014; Xiao, 2010)研究发现C. parvum基因亚型中IIc亚型只能感染人的,表现出较强的宿主特异性。
2 生活史和体外培养
2.1 生活史特征
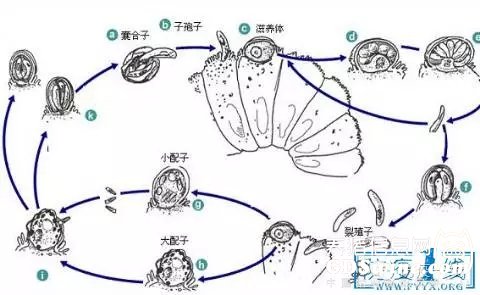
所有种类的隐孢子虫都是单一性的细胞内(胞质外)寄生虫,所有发育阶段均在一个宿主上皮细胞刷状缘的带虫空泡内进行,包括裂殖生殖、配子生殖和孢子生殖三个阶段(图1)。与球虫不同的是,隐孢子虫的孢子生殖可在体内进行,成熟的孢子化卵囊有厚壁、薄壁两种类型,薄壁卵囊直接在体内脱囊进入新一轮发育并实现持续性慢性感染;厚壁卵囊排出体外感染其他宿主,为感染阶段。孢子化卵囊是唯一的外生性阶段,随粪便排出体外,被适宜的宿主摄入之后,子孢子脱囊并侵入人、畜胃肠道或禽类的呼吸道上皮细胞。卵囊壁非常坚固,可以保护内部的子孢子抵御不良环境影响。Dumeter等(Dumetre et al., 2013)通过原子力显微镜研究发现卵囊壁组成类似普通的塑料材质。卵囊进入体内后,首先完成脱囊过程,脱囊包括一系列因素的启动,如还原条件、二氧化碳、温度、胰酶、胆盐等。卵囊壁一端的缝隙裂开,在消化道或呼吸道将子孢子逸出。子孢子侵入宿主上皮细胞后在被侵入的胞膜下与胞质间形成纳虫空泡,虫体在空泡内开始无性生殖,先发育为滋养体,经3次核分裂发育为第一代裂殖体,成熟的第一代裂殖体含有8个裂殖子,裂殖子被释出后侵入其他上皮细胞,发育为第二代裂殖体。第二代裂殖体经核分裂形成含有4个裂殖子的第二代裂殖体,中部有一较大的残体。裂殖子进一步发育为大、小配子体。小配子体进行4次分裂,形成子弹头状的16个小配子,无鞭毛和顶体,但其最前端有一个电子致密度很高的附着区,推测与受精过程密切相关。大、小配子结合受精后,形成合子,合子外层形成囊壁后即发育为卵囊,最初的卵囊原生质呈球状,继而发育成含有4个子孢子和1个残体的成熟卵囊(Hijjawi, 2010)。
图1 隐孢子虫生活史图解
隐孢子虫整个生活史在大多数宿主体内3-5d即可完成,对于免疫功能正常的个体,感染后排卵囊时间持续1-数周,后期只是间歇性的检测到卵囊;对于免疫缺陷个体,常表现出慢性、长期的感染,可持续数月之久。隐孢子虫的半数感染剂量(ID50)很低,通过对自愿接受三个不同分离株C. parvum卵囊的自愿者感染研究发现,UCP株的ID50在9-1024个卵囊之间,而IOWA株的ID50为87个卵囊(Teunis et al., 2002)。断奶前的反刍动物表现出较高的易感性。感染个体排出的卵囊数量也没有固定的数值,人工感染小牛105个卵囊,7-10d可排出109-1010个。
早在2002年Hijjawi等(Hijjawi, 2002)就发现了隐孢子虫生活史中存在一个特殊之处:即与簇虫相似的配子母细胞样(Gamont-like)细胞外发育阶段,近些年众多研究学者(Hijjawi et al., 2004; Huang et al., 2014; Koh, 2013; Koh, 2014)用实验数据不断证明了这一现象确实存在,并从人工感染72h后的小鼠动物模型中纯化出。配子母细胞样胞外生活阶段的起源和作用现在尚不明确,推测认为它是由未成功入侵宿主细胞的子孢子在细胞外发育成熟而来(Rosales, 2005)。
2.2 体外培养
隐孢子虫的体外培养一直以来都是制约隐孢子虫生物学、病原学、免疫学以及药物筛选研究发展的重要因素。无法在体外培养条件下持续性的获得卵囊,无法长时间的保存卵囊,必须通过易感实验动物定期对其传代保种,这在很大程度上制约了隐孢子虫研究的发展。6种重要人兽共患隐孢子虫中研究较为深入的依然是C. parvum。影响其体外培养的因素包括脱囊方法、时间、宿主细胞类型、培养条件等。最初的体外培养是在鸡胚上进行的,对于C. parvum和C. baileyi(贝氏隐孢子虫)都可成功的完成整个生活史,但是由于从组织中很难将隐孢子虫的各个发育阶段分开,在一定程度上限制了这种培养模型的使用范围(Current & Long, 1983; Hijjawi, 2010) 。继而众多研究学者不断探索细胞培养模型,目前用的最多的是人的结盲肠细胞(HCT-8)培养体系, 相对于其他细胞系,这个细胞系可以满足完成全部生活史获得卵囊,但卵囊的产出量非常低,且不能持续传代。本课题组近些年的研究亦发现,C. parvum 对HCT-8细胞的入侵率明显较传代细胞低,且成功入侵的许多虫体在后期没有发育,推测也可能与细胞的特异性有关。Hijjawi等(Hijjawi,2010),Karanis(Karanis & Aldeyarbi, 2011)等曾经尝试通过调整培养体系PH值、伽马射线辐照等方法将隐孢子虫的培养时间延长至25d。King等(King, 2011)通过减少脱囊培养基的用量,将脱囊后的子孢子进行离心富集后再感染细胞,可将感染率提高4倍。Castellanos-Gonzalez等(Castellanos-Gonzalez, 2013)采用从人肠道片层中分离到的完整肠隐窝作为培养载体,同时添加生长因子、 抗凋亡因子共培养,可将隐孢子虫的培养周期延长至120h。这些改进对于隐孢子虫在细胞平台上进行药物筛选研究奠定了基础。
可完成隐孢子虫整个发育阶段的无细胞培养系统是Hijjawi等(Hijjawi et al., 2004)于2004年首次提出的。利用这一培养体系,可于感染后8d获得新生成的卵囊。虽然Girouard等(Girouard et al., 2006)使用类似的无血清培养体系却没有重复出这一研究结果。但是随后的许多研究学者(Hijjawi et al., 2010; Koh et al., 2013; Zhang, 2009)证实,在无细胞培养体系中,隐孢子虫的基因组DNA含量是增加的,而且不同的发育阶段如:子孢子、滋养体、裂殖体、小配子体、胞外阶段配子母细胞样细胞等也都可通过扫描电镜等生物学技术从生物膜中鉴定到。这在一定程度上证实了隐孢子虫无细胞培养系统的可行性。Yang等(Yang et al., 2015)比较研究了细胞培养体系和无细胞培养体系中隐孢子虫不同发育阶段的生物学特征和各阶段的基因表达量差异,发现两组培养体系中隐孢子虫的基因表达谱基本相似,但是无细胞培养体系中,一些基因的表达具有延迟效应且表达量相对低。究竟这两种培养体系对隐孢子虫的体外培养存在何种差异还需要进一步的大量研究来证实,但是无细胞培养体系的建立对隐孢子虫发育生物学、药物筛选研究确实具有里程碑式的意义,它完全摆脱了动物模型或细胞。(待续)
作者:李娟,孙铭飞,张健騑*,吴彩艳,廖申权,吕敏娜,戚南山,林栩慧
作者单位:广东省农业科学院动物卫生研究所,广东省畜禽疫病防治研究重点实验室,广东省兽医公共卫生公共实验室
节选自《防疫一线》2016年第4期总47期
| 查看所有评论 最新评论 |
|
|
| 发表评论 | ||||
|