猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的急性传染病(甘孟侯等,2005)因其高致病性和高死亡率,目前该病已被确定为成为世界性的、严重制约养猪业发展的病毒性疾病之一(Wensvoort等,1991;Collins等,1992);被中国确定为一类动物疫病(Tian等,2007;Tong等,2007)。自2007年以来,该病也给越南养猪业带来重创(Nguyen等,2013)。如何更好的对该病进行防制成为兽医业者的工作重点。
现在,针对该病尚无有效的治疗方法,其主要防控途径为疫苗免疫(曹斌等,2010),实际生产中,如何选择合适的疫苗成为一个重要问题,如灭活疫苗与弱毒疫苗的选择、不同毒株弱毒疫苗间的选择等。为解决该问题,选择合适的疫苗,达到有效的防疫效果,保障生猪养殖业的健康发展,华南动物疫病检测中心在该地区开展工作,以期选择高特异性的疫苗。一方面,弱毒疫苗诱导免疫反应持续的时间较长、兼具体液免疫和细胞免疫的优势越来越被人认可(李儒曙等2012);另一方面,要根据野毒与疫苗毒株的基因序列相似性来分析、选择,即野毒与疫苗毒株基因序列相似性越高则猪群免疫效果越好,hp-PRRSV与经典型PRRSV在基因组序列上有较大的差别,一般来讲,针对hp-PRRSV必须使用高致病性猪蓝耳病疫苗才能获得良好的免疫保护力(童光志等,2007)。
报告所研究地区的hp-PRRSV是由美洲株变异而来,与中国变异株同源性较高(Nguyen等,2013),与经典株同源性低。JXA1-R株弱毒活疫苗为hp-PRRS疫苗,VR-2332株弱毒活疫苗为PRRS疫苗,两者毒株不同,虽都能免疫猪,但是免疫效果不尽相同。本研究旨在通过分析免疫后猪血液持续带毒及抗体消长规律来揭示不同毒株疫苗的免疫效果,为该地区猪场选择合适的疫苗提供理论基础,同时,也为该地区选择高特异性的疫苗达到有效的疫病防制提供参考。
1 材料与方法
1.1 试验动物 30日龄奶仔猪30头,由某大型集约化猪场提供,试验前均未接种过猪繁殖与呼吸综合症苗,健康状况良好,群体差异性小。
1.2 疫苗、试剂和仪器 高致病性猪繁殖与呼吸综合征弱毒活疫苗(JXA1-R株),广东大华农动物保健品股份有限公司生产;猪繁殖与呼吸综合征弱毒活疫苗(VR-2332株),德国某公司生产。猪繁殖与呼吸综合征病毒通用型实时荧光RT-PCR检测试剂盒(世纪元亨);LSI猪繁殖与呼吸综合征抗体检测试剂盒;实时荧光定量PCR仪(Rotor Gene Q);血液分析仪;酶标仪等。
1.3 试验设计 选取30日龄、健康状况良好、群体差异性小的断奶仔猪30头,随机分成A、B和C组,每组10头,A组每只猪注射1头份JXA1-R株hp-PRRS弱毒活疫苗,B组每只猪注射1头份VR-2332株PRRS弱毒活疫苗,C组注射相同剂量生理盐水作对照,攻毒前和攻毒后14、28、42、56、70和84d时采集抗凝血和非抗凝血,备用。
1.4 淋巴细胞数量测量 前腔静脉采血,EDTA-Na2抗凝。制备后按照普朗XF9080血液分析仪的操作说明进行白细胞数量检测。
1.5 血清PRRSV核酸实时荧光RT-PCR检测 实验室常规方法制备血清后,按照猪繁殖与呼吸综合征病毒通用型实时荧光RT-PCR检测试剂盒使用说明书进行试验操作和结果判定。胡智斌(2010)研究显示JXA1-R株疫苗在免疫后60d时疫苗毒检测为阴性,故结合该报告,本研究选择免疫后14、42和70d时检测疫苗毒存在情况,不仅符合本试验要求,更可以与前人研究形成互补。
1.6 抗体水平检测 按照LSI猪繁殖与呼吸综合征抗体检测试剂盒说明书进行试验操作和结果判定。
1.7 数据分析 数据采用X±SD的形式表示,应用SPSS统计分析软件统计,通过Duncan’s(DMRT法)比较组间差异。
2 结果与分析
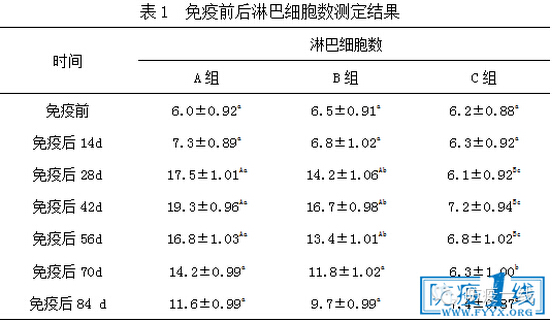
2.1 免疫前后各组淋巴细胞计数结果 结果见表1,由表1可知,免疫组在免疫后14d时淋巴细胞数增加不明显,28d后淋巴细胞数上升明显,与空白组相比差异极显著(P<0.01),且A组数量明显高与B、C两组,说明A组有较好的免疫应答。
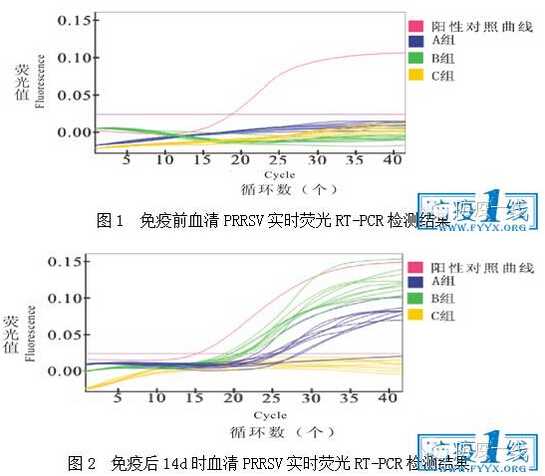
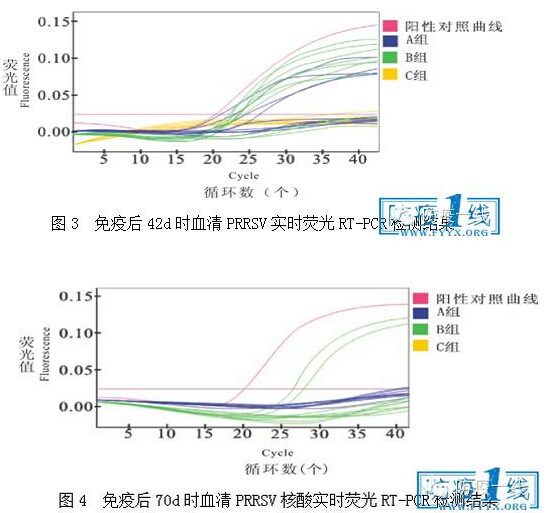
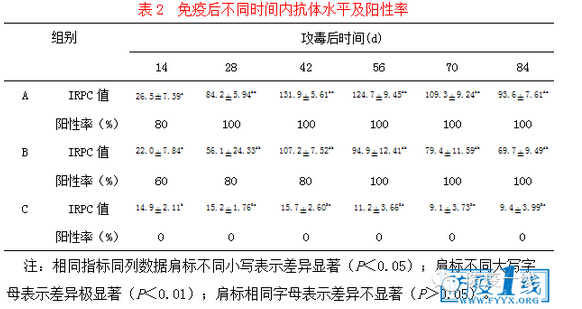
2.2.2 免疫后血清PRRSV核酸实时荧光RT-PCR检测结果 免疫后14、42和70d时血清PRRSV核酸实时荧光RT-PCR检测结果分别见图2、3和4。由图2可知,免疫后14d时,A组血清PRRSV阳性率为90%,B组为100%,C组为0;由图3可知,免疫后42d时,A组血清PRRSV阳性率为40%,B组为70%,C组为0;由图4可知,免疫后70d时,A组血清PRRSV阳性率为0,B组为80%,C组为0;说明JX1A-R株疫苗毒在试验猪体内自然消失时间短,免疫后14d左右即开始,说明该疫苗安全性高。
2.3 免疫后各组血清PRRSV抗体水平检测结果 免疫后各组血清PRRSV抗体水平检测结果见表2。由表2可知,免疫后14d,A、B、C 3组阳性率分别为80%、60%、0;免疫后28、42d,A、B、C组阳性率分别为100%、80%、0;免疫后56、70、84d,A、B、C组阳性率分别为100%、100%、0。由A、B、C各组不同时间段抗体平均水平分析可知,免疫后14d,A、B组IRPC值与C组相比差异显著(P<0.05),但A、B组间差异不显著(P>0.05);免疫后28、84d,A、B组IRPC值与C组相比差异极显著(P<0.01),A、B组间差异显著(P>0.05),同时,免疫后14-42d,A、B组IRPC值处于上升过程,42d时均达到最大,随着试验的继续,56-84d时处于顺序降低的状态,至84d时,2组均降至最低值。整个试验过程中,A组抗体100%阳性率出现时间早、持续时间长,抗体IRPC值较高、离散度较低,表明JXA1-R株疫苗免疫效果好、稳定性强。
3 讨论
在报告所研究地区,PRRSV与中国变异株亲缘关系极近(Nguyen T D T等,2013;童光志等,2007),而PRRSV不同毒株亚型间的交叉保护免疫反应小(谢印乾等,2006)是影响PRRSV免疫效果的因素之一,也就是说,如果疫苗的基因序列与某一群体存在的猪繁殖与呼吸综合征病毒基因序列相似性达到70%-80%时,疫苗才能产生较好的免疫保护作用,反之,疫苗免疫效力则较低。
鉴于PRRSV的免疫特性,单纯的体液免疫保护作用具有一定的局限性(印乾等,2006),PRRSV弱毒疫苗由于诱导免疫反应持续的时间较长兼具体液免疫和细胞免疫,具有更强的免疫优势而备受关注,区别在于,不同厂家疫苗株不同,致使不同疫苗对不同群体产生的免疫效果不一,主要体现在PRRSV特异性抗体水平的高低方面,虽然不能作为免疫水平的唯一评价指标,但是在评价疫苗免疫效力方面也具有指导意义,本试验发现,仔猪免疫后,淋巴细胞数量均上升,42d时达到最大值,尤以JXA1-R株疫苗免疫组(A组)最高,VR-2332株疫苗免疫组(B组)次之;抗体阳性率方面,28d时A组为100%,B组为80%,说明该地区猪群在接受JXA1-R株疫苗免疫后机体应答迅速、抗体产生早、抗体水平高。
另外,活疫苗在使用过程中因为减毒不彻底引发临床感染或引起免疫抑制(母安雄等,2003;王珍芹等,2005),在免疫过程中易受母源抗体影响,所以,减毒时间、抗体产生时间、抗体持续时间等也是评价疫苗优劣的指标之一,结合胡智斌(2010)的报道,有目的的选择免疫后14、42、70d以检测猪血清中疫苗毒核酸,一是与前人文献形成很好的补充,二是更适合本试验的设计。试验结果可知,免疫猪病毒核酸阳性率检测发现,42d时,JXA1-R株疫苗免疫组(A组)血清病毒核酸阳性率为40%,VR-2332株疫苗免疫组(B组)血清病毒核酸阳性率为70%;70d时,A组血清病毒核酸阳性率为0,B组为20%,说明JXA1-R株疫苗能较快诱导猪体免疫应答,而且猪群带毒现象随着时间的推移自然消除时间快,疫苗的安全性高,与前人研究结果相一致(曹斌等,2010;母安雄等,2008;胡智斌,2010)。同时,从本试验的结果看1头份免疫组达到并超过合格标准,说明按照疫苗产品所推荐的1头份免疫剂量进行免疫完全能够达到预期的效果,没有必要加大免疫剂量(陈瑞爱等,2009)。
综上所述,由于高致病性猪繁殖与呼吸综合征与传统型猪繁殖与呼吸综合征的致病病原有本质差别,必须使用专用的高致病性猪繁殖与呼吸综合征疫苗才能获得特异性的免疫保护力,这也是目前预防控制高致病性猪繁殖与呼吸综合征疫情的首选措施,应及时接种,提高猪群的特异性免疫力。无论是哪种类型的猪繁殖与呼吸综合征疫苗,只能降低猪蓝耳病的发病程度,并不能根除猪繁殖与呼吸综合征,对于猪繁殖与呼吸综合征的防控,猪场、养殖户应采取综合措施,如做好环境清洁工作、加强饲养管理、积极做好猪繁殖与呼吸综合征疫苗接种工作、不要从发病区引进猪种等。
(来源:防疫一线 作者:刘好朋,胡京京 原标题:集约化猪场猪繁殖与呼吸综合征弱毒活疫苗不同毒株免疫后血液中持续带毒及抗体消长规律研究)
| 查看所有评论 最新评论 |
|
|
| 发表评论 | ||||
|